Enoncé de l'exercice n° 1-1 : (Extrait : n°27 page 25 livre 2nde Belin Education)
Le benzaldéhyde est une molécule à l'odeur caractéristique d'amande amère. Sa synthèse étant moins couteuse que l'extraction d'amande amère, il est souvent utilisé pour parfumer les pâtisseries et certaines boissons comme le sirop d'orgeat.
On veut vérifier la composition d'une essence naturelle d'amande amère et d'une boisson à l'aide d'une chromatographie sur couche mince. Après avoir préparé la plaque, on y dépose des micro-gouttes de :
- Benzaldéhyde commercial (B)
- Essence d'amande amère naturelle (AA)
- Extrait de la boisson d'étudiée (Boisson)
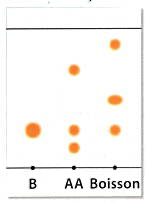
Question 1 : D'après les résultats obtenus après révélation sous U.V., indiquer si l'extrait naturel d'amande amère (AA) est constitué uniquement de benzaldéhyde (B).
Question 2 : Dire si la boisson étudiée est parfumée à l'arôme de synthèse ou à l'extrait naturel.
Question 3 : Indiquer si elle contient d'autres substances révélées par le chromatogramme.
Envoyer la proposition de travail
Lancer l'interactivité
Enoncé de l'exercice n° 1-2 : (Extrait : n°28 page 25 livre 2nde Belin Education)
Le cyclohexane est un solvant dont la masse volumique vaut 780 g.L-1.
Question 1 : Calculer la masse d'un volume de 15 mL de cyclohexane.
Question 2 : L'eau et le cyclohexane n'étant pas miscibles, déterminer le liquide surnageant quand ces deux solvants sont mélangés dans un tube à essais.
Envoyer la proposition de travail
Lancer l'interactivité
Enoncé de l'exercice n° 1-3 : (Extrait : n°32 page 26 livre 2nde Belin Education)
L'or est un métal précieux utilisé essentiellement pour fabriquer des bijoux. Mais l'or pur est trop malléable, il est donc utilisé sous forme d'alliage contenant une part plus ou moins grande d'or pur. Pour qualifier la teneur en or de l'alliage, les bijoutiers parlents de « carats ». L'or pur est un or dit de « 24 carats ».
| Alliage | Teneur en or pur |
| Or 18 carats | 18/24 |
| Or 14 carats | 14/24 |
| Or 9 carats | 9/24 |
La masse volumique de l'or pur est \(\displaystyle \rho=19,3\) g.cm-3.
Question 1 : Calculer la masse d'or pur contenu dans une bague de masse \(\displaystyle m=3,5\) g réalisée avec de l'or 18 carats.
Question 2 : Calculer le volume d'or pur correspondant.
Question 3 : Une personne achète une alliance de masse \(\displaystyle m'=2,9\) g d'or pur. Indiquer avec quel alliage ce bijou a été réalisé.
Envoyer la proposition de travail
Lancer l'interactivité
Enoncé de l'exercice n° 1-4 : (Extrait : n°36 page 27 livre 2nde Belin Education)
On présente les deux documents suivants :
 |
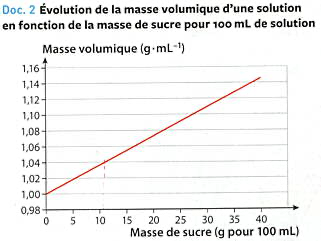 |
La courbe tracée met en évidence une droite d'équation \(\displaystyle \rho=0,00375\times m+0,997\) avec \(\displaystyle \rho\) exprimée en g.mL-1 et \(\displaystyle m\) exprimée en g.
On sait qu'une boite de 1kg de sucre en morceaux est divisée en 3 étages de 4 rangées contenant chacune 15 morceaux. Une canette contient 33 cL de soda. A vide, elle pèse 28 g et pleine, elle pèse 372 g.
Question : La quantité de sucre annoncée dans le document 2 est-elle validée ? On supposera que la masse volumique du soda est liée uniquement à la quantité de sucre qu'il contient.
Correction de l'exercice n° 1-4 :
Question : Pour valider l'information du document 1, il faut connaître la masse de sucre contenu dans la canette de soda. Pour cela, on calcule d'abord sa masse volumique \(\displaystyle \rho_{soda}\) par la formule \(\displaystyle \rho=\dfrac{m}{V}\).
Or, la canette de soda pèse à vide 28 g. Pleine, elle pèse 372 g. On en déduit que la masse de soda est \(\displaystyle m_{soda}=372-28\) soit \(\displaystyle m_{soda}=344\)g.
Ensuite, son volume est \(\displaystyle V_{soda}=330\) mL. Nous pouvons ainsi calculer sa masse volumique :
\(\displaystyle \begin{align*} \rho_{soda}&=\dfrac{m}{V} \\ &=\dfrac{344}{330} \\ &\simeq1,04 \\ \end{align*} \)
A l'aide du document 2, nous pouvons ainsi obtenir la masse de sucre contenue dans la solution de soda :
\(\displaystyle \begin{align*} \rho&=0,00375\times m+0,997 \\ 0,00375\times m+0,997&=\rho \\ 0,00375\times m&=\rho-0,997 \\ m&=\dfrac{\rho-0,997}{0,00375} \\ &\simeq12,11 \\ \end{align*} \)
La masse de sucre dans la canette de soda est donc de 12,11 g. Mais ce calcul concerne 100 mL de boisson. C'est l'indication donnée dans le document 2. Par conséquent, si pour 100 mL, on a 12,11 g de sucre alors pour 330 mL, on aura \(\displaystyle \dfrac{330\times12,1}{100}=39,93 g\)
Enfin, d'après l'énoncé, la boite contenant les \(\displaystyle 3\times4\times15=180\) morceaux de sucre pèse 1kg. Donc 7 morceaux de sucres pèsent \(\displaystyle \dfrac{7\times1000}{180}=38,88\) g. Ce qui correspond à peu près au résultat obtenu précédemment avec les 39,93 g. Nous pouvons en conclure que l'annonce du document 1 est validée.
Envoyer la proposition de travail
Lancer l'interactivité