I) Mise en situation
En classe de seconde, nous allons rencontrer trois types de transformation. La transformation physique, la transformation chimique, et la transformation nucléaire.
Nous commençons ici par la transformation physique, qui a fait l'objet déjà de quelques séquences de cours au niveau des classes du collège.
Cette séquence fait donc l'objet de quelques rappels en y ajoutant quelques notions liées aux effets des transferts thermiques au niveau des changement d'état.
Car on parle de transformations physiques, il s'agit de transformation de l'aspect physique des corps. Autrement dit, il s'agit de regarder les différentes transformations des états des corps.
II) Les changements d'états
La matière peut se présenter sous différents états. Les quatre plus connus sont l'état solide, l'état liquide, l'état gazeux et l'état plasma. En classe de seconde, nous regarderons que les trois premiers, ceux que nous rencontrons habituellement dans la vie de tous les jours.
1) Description des changements d'état
Un changement d'état d'un système est le passage de ce système d'état physique de la matière à un autre état physique de la matière.
Au cours de ce changement, les molécules qui constituent le systèmes ne changent pas.
Au collège, nous avons vu les six changements d'état possibles que nous rappelons ici :
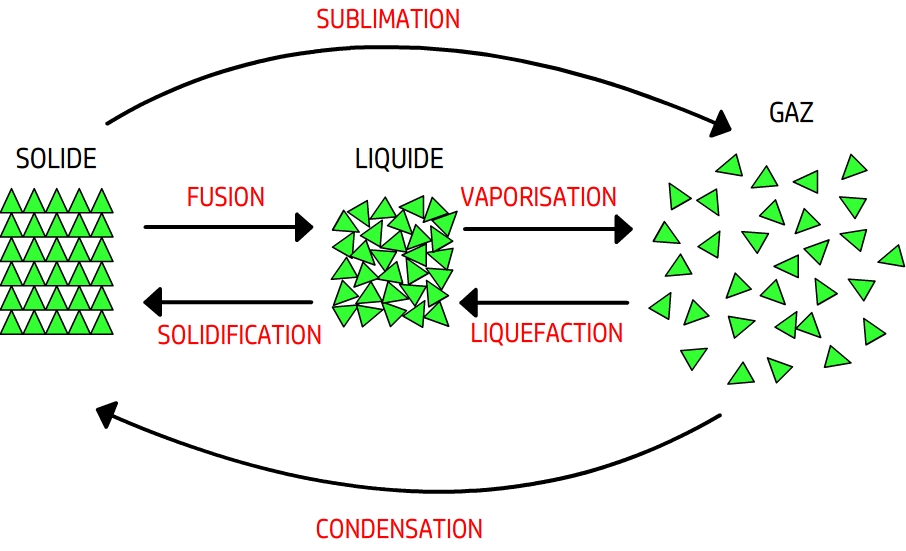
Remarque : Il ne faut pas confondre la vaporisation et l'évaporation. La vaporisation concerne un changement d'état qui se réalise à la température de changement d'état (Exemple pour l'eau à 100°C). Il y a alors ébulition. Quand à l'évaporation, elle se passe à une température inférieure, sans ébulition : l'eau de mer ne bout pas lorsqu'elle s'évapore !
Enfin, nous rappelons que la température de changement d'état est constante pour un corps pur. En revanche, pour un mélange, la température lors du changement d'état varie.
2) Ecriture symbolique du changement d'état
On utilise une écriture symbolique dans les équations de réaction chimique pour spécifier l'état du corps ou de la molécule mise en action. Ainsi, le changement d'état d'une espèce chimique se symbolise par une équation du même typê qu'une transformation chimique.
Ces états physiques sont représentés par une lettre entre parenthèses : (s) pour solide, (l) pour liquide et (g) pour gaz.
Exemple : Le changement d'état de la vaporisation de l'eau s'écrit : \(\displaystyle \newcommand{\chimie}[1]{\mathrm{#1}} \newcommand{\chimiecite}[1]{\mathrm{#1}} \newcommand{\nchim}{\mathit{n}} \chimiecite{H_2O_{(l)} \longrightarrow H_2O_{(g)}} \)
3) interprétation microscopique
A l'échelle microscopique, les entités d'un sytème étudié ont un mouvement permanent (rotaion, vibration, translation) dû à l'agitation thermique.
Cette agitation thermique est plus intense si le système absorbe de l'énergie thermique. Au contraire, s'il libère de l'énergie thermique, l'agitation thermique se fait moins intense.
Dans le cas précis où le système se situe à une tempérture de changement d'état, des échanges d'énergie peuvent mener les entités à changer leur arrangement : on assiste alors à un changement physique : c'est le changement d'état.
III) Aspects énergétiques des changements d'état
Nous venons de voir qu'à l'échelle microscopique, de l'énergie est échangée. Nous avons le cas où le système reçoit l'énergie et celui où il en donne.
1) Transformations exothermiques et endothermiques
Le vocabulaire employé est le suivant :
Définition : Lorsque le système tend vers un assemblage des molécules de plus en plus ordonnées (solidification, liquéfaction ou condensation), le système doit libérer de l'énergie : la transforamtion plysique est exothermique.
Définition : Lorsque le système tend vers un assemblage des molécules de moins en moins ordonnées (fusion, vaporisation ou sublimation), le système doit absorber de l'énergie : la transforamtion plysique est endothermique.
2) Energie de changement d'état
Lors du passage d'un état plus ordonné à un autre état moins ordonné, un corps a besoin d'une quantité d'énergie. C'est par exemple le cas de l'eau à 100°C dans la casserole, il faut continuer à fournir de l'énergie pour que l'eau se vaporise.
Aussitôt l'apport d'énergie coupé, l'eau ne bout plus, tout en restant à 100°C à la pression de 1 bar.
Cette quantité d'énergie qui permet le changement d'état est définie de la façon suivante :
Définition : Pour un changement d'état, la quantité d'énergie à fournir est notée \(\displaystyle Q\). Elle s'exprime en joule (J) et se calcule par \(\displaystyle Q=mL\), avec \(\displaystyle m\), la masse de l'échantillon en kilogramme (kg) et \(\displaystyle L\), l'énergie massique de transformation propre à l'échantillon exprimée en J.kg-1.
Remarque : L'énergie de transformation propre à l'échantillon est appelée aussi la chaleur latente. Cette quantité d'énergie a la même valeur pour une transformation et celle opposée : \(\displaystyle L_{vaporisation}=-L_{liquefaction}\).
On rappelle encore que la température de changement d'état d'un corps pur est fixe et constante, à une pression donnée. Il est ainsi possible de vaporiser de l'eau à une température de plus de 100°C en augmentant la pression. C'est le phénomène qui se passe dans les auto-cuiseur du type cocotte minute.