I) Mise en situation
Dans la séquence n°4, nous avons apporté quelques connaissances sur constitution de l'atome, et en particulier celle du noyau.
Nous allons regardé cette fois-ci dans cette séquence, ce qu'il en est des électrons qui sont situés autour du noyau et qui constitue le cortège électronique.
Pour cela, nous allons retracer les travaux de Dimitri Mendeleïev (1834 - 1907) au travers de la séance d'activité documentaire d'introduction, disponible par le lien : Activité documentaire n°3
II) Le cortège électronique de l'atome
La découverte de l'atome et ses constituants ne s'est pas réalisée en quelques jours. Elle a commencé quelques siècles avant notre ère et continue à ce jour d'évoluer grâce à la mécanique quantique.
1) Introduction
Il faut attendre le début du XIX siècle pour que la première théorie atomique apparaisse par John Dalton. C'est ensuite Joseph John Thomson en 1904 qui parle d'un premier constituant de l'atome : l'électron. Il suppose que l'atome est formé comme un pudding.
C'est ensuite en 1910 que Rutherford propose une expérience sur une feuille d'or qui lui permet de décrire l'atome comme étant constitué d'électrons qui « tournent » autour du noyau comme le font les planètes autour du Soleil.
Cette description apporte des limites et c'est Niels Bohr en 1910 qui complète cette description en ajoutant que les électrons sont situés autour du noyau, sous forme de couche, toujours sur l'idée des orbites des planètes.
Mais ce modèle amène toujours des limites et des erreurs. Quand est-il alors de cette configuration électronique ?
La mécanique quantique apparait au début des années 1920, toujours avec Niels Bohr, Max Planck et Albert Eintsein. On ne parle plus de l'électron qui décrit une orbite autour du noyau comme le ferait une planète autour du Soleil.
On parle plutôt d'une probabilité que l'électron soit positionné à un tel endroit et doté d'une certaine vitesse. Cette probabilité sur l'espace occupé par cet électron ne s'appelle plus donc une orbite mais une orbitale.


Le mot « orbitale » n'est pas à retenir car il n'est pour le moment pas au programme de la classe de seconde. Il faut retenir que l'électron est supposé se trouver à un certain endroit avec une certaine probabilité. On parle en effet de probabilité car dés qu'on observe un électron, on utilise de la lumière et on modifie ainsi sa position et sa vitesse.
2) Configuration électronique
Les résultats de la mécanique quantique (résolution de l'équation de Schrödinger), prévoient plusieures régions de l'espace où peuvent se situer les électrons. Ces régions (appelées orbitales) seront appelées en classe de seconde sous-couche. L'appartenance à ces sous couches dépend de l'état de l'électron dans lequel il se trouve. Cet état dépend de quatre nombres. Nous verrons en classe de seconde que les deux premiers. Il s'agit du numéro de la couche et du numéro de la sous-couche.
- Le premier nombre est le numéro de la couche : \(\displaystyle n=1\), \(\displaystyle n=2\), \(\displaystyle n=3\), etc. Auparavant, on appelait ces couches par des lettre majuscules : la couche K, puis la couche M, puis la couche N, etc. Mais cette notation n'est plus vraiment utilisée.
- Le deuxième nombre est le numéro de la sous-couche : \(\displaystyle l=0\), \(\displaystyle l=1\), \(\displaystyle l=2\), etc. Ces sous-couche sont appelée aussi par des lettres. Ces lettres sont minuscules : \(\displaystyle s\), \(\displaystyle p\), \(\displaystyle d\), \(\displaystyle f\), etc...
A savoir : Pour les dix-huit premiers atomes de la classification périodique, les électrons sont répartis dans des couches électroniques numérotées de 1 à 3. La première couche n°1 n'est constituée que d'une sous-couche appelée sous-couche \(\displaystyle s\). Les deux autres couches n°2 et °3 contiennent les sous-couches \(\displaystyle s\) et \(\displaystyle p\).
A savoir : La sous-couche \(\displaystyle s\) peut contenir jusqu'à deux électrons. La sous-couche \(\displaystyle p\) peut contenir jusqu'à six électrons.
Voici une méthode qui permet de donner la configuration électronique d'un atome dans son état fondamental. Il faut noter que cette méthode ne s'applique qu'au dix-huit premiers atomes de la classification périodique. Au delà, il faut utiliser d'autres méthodes qui seront vues après le baccalauréat.
- Etape 1 : on remplit en premier la couche n°1. Elle ne contient que la sous-couche \(\displaystyle s\). Cette sous-couche ne contient que deux électrons.
- Etape 2 : lorsque cette première couche est pleine (on dit qu'elle est saturée), on remplit alors la couche n°2 en commençant par la sous-couche \(\displaystyle 2s\) puis la sous-couche \(\displaystyle 2p\). Notez qu'on place devant la lettre \(\displaystyle s\) ou \(\displaystyle p\), le numéro de la couche principale. On rappelle que la sous-couche \(\displaystyle s\) ne contient que deux électrons et que la sous-couche \(\displaystyle p\) ne contient que 6 électrons.
- Etape 3 : lorsque cette deuxième couche est saturée, on remplit alors la couche n°3 en commençant par la sous-couche \(\displaystyle 3s\) puis la sous-couche \(\displaystyle 3p\).
A savoir : La dernière couche remplie par des électrons est appelée la couche externe. Les autres couches saturées, proches du noyau sont appelées les couches internes.
A savoir : La couche externe est aussi appelée la couche de valence. Les électrons qui se trouvent sur cette couche de valence sont appelés les électrons de valmence. Les électrons situés sur les couches internes sont appelés les électrons de coeur.
Exemple : Prenons en guise d'exemple l'atome de sodium Na. Son numéro atomiques est \(\displaystyle Z=11\). Il possède donc 11 protons et donc 11 électrons. Suivant la méthode, on commence à remplir la première couche et sa sous-couche \(\displaystyle 1s\). On ne peut placer que deux électrons sur cette sous-couche. On notera alors ce placement par \(\displaystyle 1s^2\). On passe ensuite à la deuxième couche qui contient la sous-couche \(\displaystyle 2s\) et \(\displaystyle 2p\). On place deux électrons sur \(\displaystyle 2s\) et 6 électrons sur \(\displaystyle 2p\). On note alors \(\displaystyle 2s^2\) et \(\displaystyle 2p^6\). Il nous reste un électron à placer. On arrive alors à la troisième couche et on place de dernier électron sur la sous-couche \(\displaystyle 3s\). Ce qui donne finalement la configuration électronique du sodium : \(\displaystyle 1s^2\) \(\displaystyle 2s^2\) \(\displaystyle 2p^6\) \(\displaystyle 3s^1\). Sa couche de valence n'est constituée que d'un seul électron.
3) Position dans le tableau périodique de mendeleïev
La séance d'activité documentaire n°4 permet de retracer les travaux de Dimitri Mendeleiëv en 1869. Il propose de classer les éléments dans un tableau selon certains critères. Ces critères ont été modifiés par Van Den Broeck :
- les éléments chimiques sont classés par numéro atomique croissant.
- les élements dont la couche de valence contient le même nombre d'électrons sont placés dans la même colonne.
- lune nouvelle ligne de la classification est entamée dés lors que le remplissage d'une nouvelle couche électronique est entamée.
On obtient alors un phénomène de périodicité. On présente ici les trois premières périodes de cette classification :
| H | He | ||||||
| Li | Be | B | C | N | O | F | Ne |
| Na | Mg | Al | Si | P | S | Cl | Ar |
Leur classification électronique donne :
| H | \(\displaystyle Z=1\) | \(\displaystyle 1s^1\) |
| He | \(\displaystyle Z=2\) | \(\displaystyle 1s^2\) |
| Li | \(\displaystyle Z=3\) | \(\displaystyle 1s^2\) \(\displaystyle 2s^1\) |
| Be | \(\displaystyle Z=4\) | \(\displaystyle 1s^2\) \(\displaystyle 2s^2\) |
| B | \(\displaystyle Z=5\) | \(\displaystyle 1s^2\) \(\displaystyle 2s^2\) \(\displaystyle 2p^1\) |
| C | \(\displaystyle Z=6\) | \(\displaystyle 1s^2\) \(\displaystyle 2s^2\) \(\displaystyle 2p^2\) |
| N | \(\displaystyle Z=7\) | \(\displaystyle 1s^2\) \(\displaystyle 2s^2\) \(\displaystyle 2p^3\) |
| O | \(\displaystyle Z=8\) | \(\displaystyle 1s^2\) \(\displaystyle 2s^2\) \(\displaystyle 2p^4\) |
| F | \(\displaystyle Z=9\) | \(\displaystyle 1s^2\) \(\displaystyle 2s^2\) \(\displaystyle 2p^5\) |
| Ne | \(\displaystyle Z=10\) | \(\displaystyle 1s^2\) \(\displaystyle 2s^2\) \(\displaystyle 2p^6\) |
| Na | \(\displaystyle Z=11\) | \(\displaystyle 1s^2\) \(\displaystyle 2s^2\) \(\displaystyle 2p^6\) \(\displaystyle 3s^1\) |
| Mg | \(\displaystyle Z=12\) | \(\displaystyle 1s^2\) \(\displaystyle 2s^2\) \(\displaystyle 2p^6\) \(\displaystyle 3s^2\) |
| Al | \(\displaystyle Z=13\) | \(\displaystyle 1s^2\) \(\displaystyle 2s^2\) \(\displaystyle 2p^6\) \(\displaystyle 3s^2\) \(\displaystyle 3p^1\) |
| Si | \(\displaystyle Z=14\) | \(\displaystyle 1s^2\) \(\displaystyle 2s^2\) \(\displaystyle 2p^6\) \(\displaystyle 3s^2\) \(\displaystyle 3p^2\) |
| P | \(\displaystyle Z=15\) | \(\displaystyle 1s^2\) \(\displaystyle 2s^2\) \(\displaystyle 2p^6\) \(\displaystyle 3s^2\) \(\displaystyle 3p^3\) |
| S | \(\displaystyle Z=16\) | \(\displaystyle 1s^2\) \(\displaystyle 2s^2\) \(\displaystyle 2p^6\) \(\displaystyle 3s^2\) \(\displaystyle 3p^4\) |
| Cl | \(\displaystyle Z=17\) | \(\displaystyle 1s^2\) \(\displaystyle 2s^2\) \(\displaystyle 2p^6\) \(\displaystyle 3s^2\) \(\displaystyle 3p^5\) |
| Ar | \(\displaystyle Z=18\) | \(\displaystyle 1s^2\) \(\displaystyle 2s^2\) \(\displaystyle 2p^6\) \(\displaystyle 3s^2\) \(\displaystyle 3p^6\) |
La position d'un élément est déterminée par sa configuration électronique de valence : le numéro de la couche indiquant la période (ou ligne), le nombre d'électrons de valence déterminant la famille (colonne).
Remarque : L'hélium a volontairement été déplacé pour le placer dans la colonne où la dernière couche est saturée (la couche de valence complète).
4) Famille chimique
Les propriétés chimiques et physiques des éléments dépendent du nombre d'électrons figurant sur la couche de valence. Ainsi, les éléments qui se situent dans la même colonne obtiennent des propriétés chimiques et physiques similaires.
On distingue plusieurs familles d'éléments. Les principaux à retenir en classe de seconde est la famille des alcalins, des halogènes et des gaz nobles.
• Les alcalins
Les alcalins sont situés à l´extrême gauche du tableau périodique et sont tous des métaux. Ils n´ont qu´un électron de valence (famille Ia) et auront donc tendance à donner facilement cet électron pour saturer le niveau d´énergie et à former un cation de charge +1 : Li+, Na+, K+, …
Les alcalins doivent être conservés dans l´huile, car lorsqu´ils sont en contact avec l´eau ou l´air, ils réagissent violemment pour former une base hydroxylée ou alcaline.
Les alcalins sont souvent utilisés dans la médecine pour la fabrication des médicaments et pour la fabrication d´explosifs.
Remarque : L´hydrogène, même s´il fait partie du groupe IA comme tous les éléments mentionnés plus haut, ne fait pas partie de la famille des alcalins, contrairement à ce qu´on peut penser. L´hydrogène peut être considéré comme un élément à part. C´est l´élément le plus léger : il n´est formé que d´un proton et d´un électron. C´est l´élément le plus commun dans l´univers.
• Les alcalino-terreux
Les alcalino-terreux possèdent deux électrons de valence (famille IIa) et auront donc tendance à donner facilement deux électrons pour saturer le niveau d´énergie et à former un cation de charge +2 : Be2+, Mg2+, Ca2+, ...
Ces éléments ne se trouvent jamais sous forme métallique libre dans la nature, car, comme les alcalins, ils sont très réactifs et réagissent aisément avec de nombreux non-métaux
• Les métaux de transition
Tous les membres de cette famille sont des métaux et n´obéissent pas à la règle de l´octet. En effet, ils peuvent accueillir plus de 8 électrons sur leur couche de valence.
Certains d´entre eux peuvent même en accueillir jusqu´à 18. Cela rend parfois difficiles les interactions avec les éléments des autres familles.
Ils ont aussi, pour la plupart, tendance à s´unir entre-eux, ou encore avec des composés d´autres familles pour former ce que l´on appelle des alliages.
• Les terreux
Cette famille est aussi connue sous le nom de "famille du bore". Ils comptent 3 électrons de valence (famille IIIa) , et auront donc tendance à donner facilement trois électrons pour saturer le niveau d´énergie et à former un cation de charge +3 : B3+, Al3+, ...
Le digne représentant de cette famille (du moins, celui qui lui donne son nom) est un élément appartenant aux métalloïdes; les 4 autres sont des métaux
• Les carbonides
Cette famille, appelée aussi "famille du carbone", sort vraiment de l´ordinaire par rapport aux autres familles du tableau périodique. Ses membres possèdent tous quatre électrons de valence (famille IVa) . Ils peuvent en céder ou en attirer pour se saturer et former respectivement un cation de charge +4 ou un anion de charge -4.
Le carbone C, le silicium Si et le germanium Ge sont des métalloïdes.
L´étain Sn et le plomb Pb sont des métaux.
• Les azotides
Les azotides possèdent 5 électrons de valence (famille Va) et auront donc tendance à attirer 3 électrons pour obéir à la règle de l´octet et à former une anion de charge -3 : N3-, P3-, ...
Les éléments les plus importants sont certainement l´azote et le phosphore, éléments essentiels à la vie des animaux et des végétaux et dont nombreux de leurs composés ont des applications importantes.
• Les sulfurides
Les sulfurides possèdent 6 électrons de valence (famille VIa) et auront donc tendance à attirer 2 électrons pour obéir à la règle de l´octet et à former une anion de charge -2 : O2-, S2-, ...
Les sulfurides prennent donc volontiers deux électrons à ceux qui s´y risquent. Ils font des liens ioniques avec les autres familles de la région des métaux, aussi bien que des liens covalents avec nos semblables, les non-métaux.
• Les halogènes
Les halogènes ont tous sept électrons de valence, (famille VIIa) et ont donc tendance à attirer un électron pour obéir à la règle de l´octet et à former une anion de charge -1 : F-, Cl-, ...
Les halogènes ne se laissent pas marcher sur les pieds. Ils n´hésitent pas à s´emparer de l´électron qui leur manque. C´est pour cela qu´ils sont reconnus comme étant la famille la plus avare du tableau périodique.
• Les gaz rares
Les gaz rares ont 8 électrons de valence, sauf l´hélium, ils possèdent dons une structure bien stable (huit électrons sur la couche de valence) et ils ne sont pas intéressés à donner ou à recevoir des électrons.
Il y a quelques années, les gaz rares étaient appelés gaz inertes à cause de leur inertie chimique. Mais on sait maintenant qu´ils peuvent néanmoins réagir avec d´autres gaz.
Ce sont les seuls gaz monoatomiques, tous les autres gaz ont des molécules diatomiques c´est-à-dire qu´il y a deux atomes d´un même élément qui composent la molécule.
La source des gaz rares est l´air.
III) Notion de stabilité chimique
Nous venons de voir dans la déscritpion des familles que tel ou tel élément était capable de former tel ou tel ion. Nous allons comprendre ici de quelle manière cela se produit.
1) Ions monoatomiques
A partir des configurations électroniques des atomes, il est possible de prévoir quels ions vont être formés. Seuls les atomes possédant une couche de valence saturée sont électroniquement stables. Il s'agit des gaz nobles ou gaz rares. Les autres atomes peuvent alors gagner ou perdre des électrons pour retrouver cette stabilité et avoir une couche de valence saturée et donc de ne plus avoir de couche de valence incomplète. Pour cela, la solution permettant d'échanger le moins d'électrons est toujours privilégiée :
| Nom de l'ion | Formule chimique | Commentaire |
| ion hydrogène | H+ | La couche de valence de l'hydrogène est \(\displaystyle 1s^2\). Pour la saturer, il lui faut un autre électron ou en perdre un. Il est plus facile d'en perdre un. Ce qui donnera alors juste le noyau sans électron. D'où l'ion H+. |
| ion sodium | Na+ | La couche de valence du sodium est \(\displaystyle 3s^1\). Pour saturer la dernière couche, il lui faut un électron ou en perdre un. Il est plus facile d'en perdre un. Ce qui donnera alors la dernière couche \(\displaystyle 2p^6\). D'où l'ion Na+. |
| ion potassium | K+ | La couche de valence du potassium est \(\displaystyle 4s^1\). Pour saturer la dernière couche, il lui faut gagner sept électrons ou en perdre un. Il est plus facile d'en perdre un. Ce qui donnera alors la dernière couche \(\displaystyle 3p^6\). D'où l'ion K+. |
| ion calcium | Ca2+ | La couche de valence du calcium est \(\displaystyle 4s^2\). Pour saturer la dernière couche, il lui faut gagner 16 électrons ou en perdre deux. Il est plus facile d'en perdre deux. Ce qui donnera alors l'ion Ca2+. |
| ion magnésium | Mg2+ | La couche de valence du magnésium est \(\displaystyle 3s^2\). Pour saturer la dernière couche, il lui faut gagner 6 électrons ou en perdre deux. Il est plus facile d'en perdre deux. Ce qui donnera alors l'ion Mg2+. |
| ion chlorure | Cl- | La couche de valence du chlore est \(\displaystyle 3s^2\) \(\displaystyle 3p^5\). Pour saturer la dernière couche, il lui faut gagner un électron ou en perdre sept. Il est plus facile d'en gagner un. Ce qui donnera alors l'ion Cl-. |
| ion fluorure | H+ | La couche de valence du fluor est \(\displaystyle 2s^2\) \(\displaystyle 2p^5\). Pour saturer la dernière couche, il lui faut gagner un électron ou en perdre sept. Il est plus facile d'en gagner un. Ce qui donnera alors l'ion F-. |
2) Schéma de Lewis d'une molécule
Au niveau de la couche de valence, les électrons sont regroupés par deux. La réunion de deux électrons est appelé un doublet représenté par une barre au niveau du symbole de l'atome. Lorsqu'il reste un seul électron, il est représenté par un point.
Pour compléter la couche de valence, les électrons se lient avec ceux d'un autre atome. Ce qui compose alors un doublet, mais cette fois-ci, il sera qualifié de liant.
On distingue alors les doublets liants et les doublets non-liants. Ces derniers sont responsables de la liaison covalente.
Exemple : L'acide chloridrique est formé d'un atome d'hydrogène H et d'un atome de chlore Cl. Les configurations électroniques de chaque atome donne :
- H : \(\displaystyle Z=1\) : \(\displaystyle 1s^1\)
- Cl : \(\displaystyle Z=17\) : \(\displaystyle 1s^2\) \(\displaystyle 2s^2\) \(\displaystyle 2p^6\) \(\displaystyle 3s^2\) \(\displaystyle 3p^5\)
L'unique électron de l'hydrogène ne va pas former de doublet non-liant. L'atome va proposer son électron à l'atome de chlore pour saturer sa dernière couche (\(\displaystyle 3p^5\)). Il va alors se former un doublet liant : une liaison covalente.
Le chlore dispose ensuite de 3 doublets non liants au niveau de sa couche externe. Ce qui donne la schématisation de Lewis :
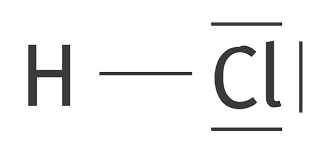
3) Energie de liaison
Les molécules étant plus stables que les atomes isolés, pour rompre une liaison chimique reliant deux atomes d'une molécule, il lui faut fournir une énergie appelée énergie de liaison.
| Liaison | H-H | C-H | C-C | O-H | C-O | O=O | C=O (pour CO2) | C=O (pour autre) |
| Energie en kJ.mol-1 | 432 | 413 | 348 | 463 | 358 | 498 | 804 | 730 |