I) Mise en situation
Pour introduire la description microscopique de la matière, nous proposons les séances de travaux pratiques suivante :
II) De l'espèce chimique à l'entité
Une espèce chimique à l'échelle macroscopique est une collection très élevée d'entités qui peuvent être des atomes, des ions ou des molécules.
On rappelle qu'une molécule est une association d'atomes qui sont liés par des interactions définies plus tard, et qu'un ion est un atome qui perdu ou gagné, un ou plusieurs électrons.
Ainsi, pour comprendre la formation des molécules et des ions, il devient indispensable de bien connaître la structure de l'atome.
III) Description de l'atome
La notion d'atome a été vue au cycle 4 du collège. Nous allons ici revoir les notions aquises et être plus précis sur l'echelle subatomique.
1) Structure de l'atome
A tout niveau, on peut donner une première définiton de l'atome de la façon suivante :
Définition : L'atome est un édifice constitué d'un noyau autour duquel des électrons sont en mouvement.
Propriété : Le noyau est chargé positivement et les électrons sont chargés négativement. L'atome est globalement neutre : c'est l'électroneutralité.
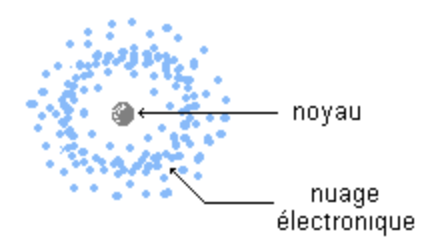
2) Noyau de l'atome
De la même façon, on peut donner une définition du noyau ainsi que quelques propriétés :
Définition : Le noyau est constitué de nucléons. Il existe deux types de nucléons : les protons et les neutrons.
Propriété : La masse du proton est \(\displaystyle m_p=1,6726\times10^{-27}\) kg et porte une charge \(\displaystyle q_p=e\) C.
On rappelle que la charge élémentaire \(\displaystyle e\) a pour valeur \(\displaystyle e=1,6\times10^{-19}\) C.
Propriété : La masse du neutron est \(\displaystyle m_n=1,6749\times10^{-27}\) kg et porte une charge \(\displaystyle q_n=0\) C.
On remarque que \(\displaystyle m_p\simeq m_n\). On pourra alors assimiler la masse du proton comment étant égale à celle du neutron, et donc égale à celle d'un nucléon.
Afin de décrire facilement le noyau, deux nombres sont définis :
Définition :
- Le nombre \(\displaystyle A\) est le nombre de nucléons : il représente donc le nombre de protons et de neutrons.
- Le nombre \(\displaystyle Z\) est le numéro atomique : il représente donc le nombre de protons ou celui d'électrons.
A partir de ces deux nombres, on peut calculer le nombre de neutrons \(\displaystyle N\) par \(\displaystyle N=A-Z\).
Aussi, les masses des protons et des neutrons étant très proches, le nombre \(\displaystyle A\) est aussi appelé le nombre de masse.
3) Cortège électronique
Le cortège électronique représente tous les électrons qui sont en mouvement autour du noyau.
Propriété : La masse de l'électron est \(\displaystyle m_e=9,1\times10^{-31}\) kg et porte une charge \(\displaystyle q_e=-e\) C.
Il est cohérent de dire que l'atome est électriquement neutre car la charge d'un proton étant \(\displaystyle q_p=e\) et celle d'un électron étant \(\displaystyle q_e=-e\), sont opposées. On rappele que la charge d'un neutron est nulle.
4) Masse de l'atome
Avec la propriété précédente, on s'apperçoit que la masse d'un électron est environ 10 000 fois plus petite que celle d'un nucléon. On peut alors négliger la masse de l'électron devant celle d'un nucléon. Ainsi, la masse d'un atome se résume à celle de son noyau. Son calcul s'effectue par \(\displaystyle m_{noyau}=A\times m_{nucleon}\).
5) Ordre de grandeur, structure lacunaire
Si les atomes et leurs noyaux ont une taille variable selon leur nature, l'ordre de grandeur du diamètre d'un atome est de \(\displaystyle 10^{-10}\) m. Une unité spécifique a même été donnée dans ce sens : l'Angtröm.
L'ordre de grandeur du noyau est de \(\displaystyle 10^{-15}\) m. La taille d'un électron est négligeable devant celle des autres. Par conséquent, un grand espace vide sépare le noyau des électrons. L'atome est majoritairement constitué de vide : on dit que l'atome a une structure lacunaire.
IV) L'élément chimique
On définit l'élément chimique de la façon suivante :
1) Définition
Définition : L'élément chimique est défini par le nombre de protons contenus dans le noyau de l'atome, soit son numéro atomique \(\displaystyle Z\).
Au cours d'une réaction chimique, les éléments chimiques sont concervés.
Quelques exemples d'éléments chimiques couramment utilisés :
| Numéro atomique | 2 | 6 | 11 | 20 | 47 | 92 |
| Nom de l'élément | Hélium | Carbone | Sodium | Calcium | Argent | Uranium |
| Symbole chimique | He | C | Na | Ca | Ag | U |
2) Représentation symbolique du noyau d'un atome
Le noyau d'un atome est représenté par son symbole auquel on place le nombre de masse \(\displaystyle A\) et le numéro atomique \(\displaystyle Z\). Cela donne \(\displaystyle ^{79}_{35}\text{Br}\)
Exemple, pour l'élément carbone, on note \(\displaystyle ^{12}_{6}\text{C}\) et pour l'or : \(\displaystyle ^{197}_{79}\text{Au}\)
3) Isotopes
On rappelle que le numéro atomique définit l'élément chimique. Mais cet élément peut exister avec un nombre différent de neutrons et donc avec un nombre différents de nucléons et par conséquent un nombre différent de masse.
1) Définition
On définit l'élément chimique de la façon suivante :
Définition : Des atomes qui ont le même numéro atomique avec un nombre de neutron (ou nombre de masse) différent, sont appelés des isotopes.
Remarque : L'isotope d'un élément est souvent appelé par son nom puis de son numéro de masse correspondant : par exemple : le carbonne 14 pour \(\displaystyle ^{12}_{6}\text{C}\).
V) Les ions et composés ioniques
Le concept d'ion a été aperçu au cycle 4 du collège.
1) Les ions
On rappelle une définition d'un ion :
Définition : Un ion est formé lorsqu'un atome gagne ou perd un ou plusieurs électrons.
Ainsi, contrairement à l'atome, l'ion n'est plus éléctriquement neutre car le cortège électronique dispose d'un nombre d'électrons différent à celui des protons. On dit que l'ion est chargé :
Définition :
Lors de la perte d'un ou plusieurs électrons, l'ion formé est chargé positivement, c'est un cation.
Lors du gain d'un ou plusieurs électrons, l'ion formé est chargé négativement, c'est un anion.
Quelques exemples d'ions couramment utilisés :
| Atome | Hydrogène | Magnésium | Souffre | Chlore | Fer |
| Nombre d'électrons échangés | 1 perdu | 2 perdus | 2 gagnés | 1 gagné | 3 perdus |
| ion formé | \(\displaystyle \text{H}^+\) | \(\displaystyle \text{Mg}^{2+}\) | \(\displaystyle \text{S}^{2-}\) | \(\displaystyle \text{Cl}^-\) | \(\displaystyle \text{Fe}^{3+}\) |
2) Les composés ioniques
On définit un composé ionique de la façon suivante :
Définition : Un composé ionique, appelé aussi cristal ionique, est un solide constitué d'anions et de cations disposés de manière régulière et ordonnée.
La quantité de chaque type d'io dans le cristal dépend de sa charge lors de son passage en solution. On indique (s) sous la formule chimique du solide ionique et (aq) sous les ions solvatés par l'eau (en solution aqueuse).
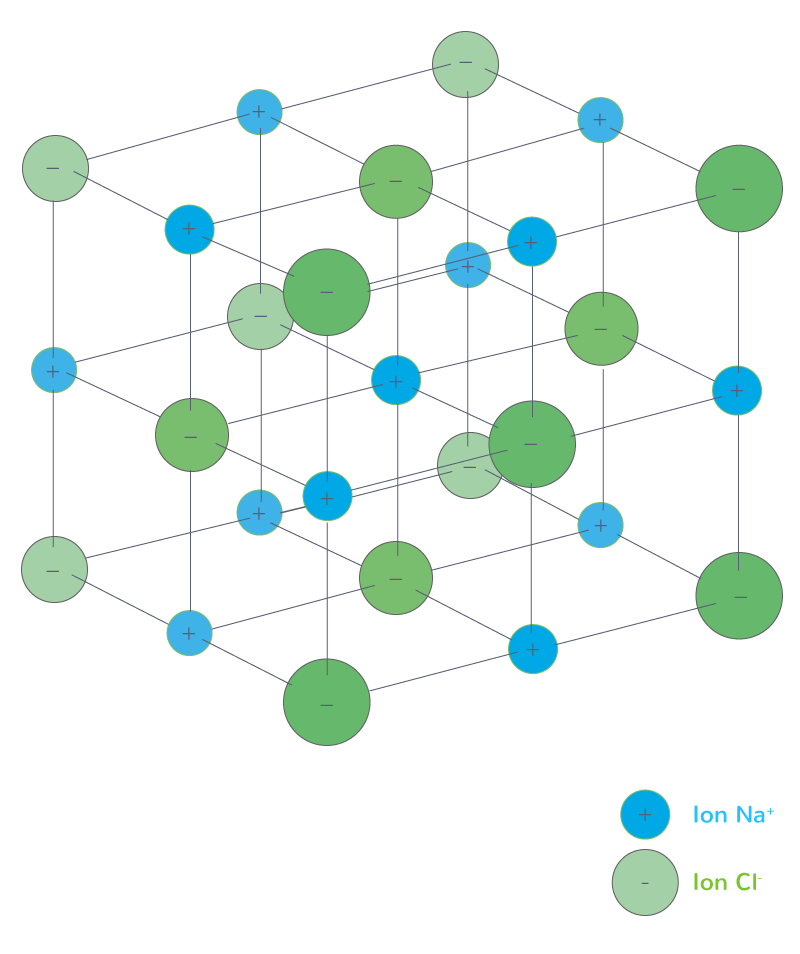
NaCl solide est formé d'ions Na+ et Cl- en quantités égales. Son équation de dissolution est NaCl(s) \(\displaystyle \longrightarrow\) Na+(aq) + Cl-(aq).
CaCl2 solide est formé de deux fois plus d'ions Cl- que d'ions Ca2+. Son équation de dissolution est CaCl2(s) \(\displaystyle \longrightarrow\) Ca2+(aq) + 2Cl-(aq).