I) Mise en situation
Pour introduire la notion de corps purs et de mélanges, nous proposons les séances d'activité expérimentale suivante :
II) Notions de corps purs et de mélanges
La notion de corps pur ou de mélange fait preuve de beaucoup de confusions. Il est important de commencer à rappeler quelques définitions.
1) Définitions
Le corps pur et le mélange se définissent de la façons suivante :
Définition : Un corps pur est une substance composée d'une seule espèce chimique.
Définition : Un mélange est une substance composée d'un moins deux espèces chimiques. Parmi les mélanges, on nomme mélange homogène tout mélange dont on ne peut discerner les différents constituants à l'oeil nu. Dans le cas contraire, le mélange est dit hétérogène.
2) Composition massique d'un mélange
La composition massique d'un mélange informe des proportions du mélange en ses différents constituants. Elle s'exprime par un simple rapport de la masse \(\displaystyle m\) du constituant étudié au sein du mélange, par la masse totale \(\displaystyle m_T\) du mélange. Ce rapport s'écrit ainsi \(\displaystyle \dfrac{m}{m_T}\).
Multiplié par 100, le résultat devient un pourcentage. Il n'a donc pas d'unité à condition que les unités des deux masses doivent être identiques.
3) Composition volumique d'un mélange
La composition volumique d'un mélange informe des proportions du mélange en ses différents constituants. Elle s'exprime par un simple rapport de le volume \(\displaystyle V\) du constituant étudié au sein du mélange, par le volume totale \(\displaystyle V_T\) du mélange. Ce rapport s'écrit ainsi \(\displaystyle \dfrac{V}{V_T}\).
Multiplié par 100, le résultat devient un pourcentage. Il n'a donc pas d'unité à condition que les unités des deux volumes doivent être identiques.
Remarque : Contrairement à la masse, le volume d'un constituant dépend de la température et de la pression. Le pourcentage volumique d'un constituant peut donc varier selon les conditions de mesures, à savoir selon la température et la pression.
Cf. : Exemple.
III) Identification des espèces chimiques
Concernant les mélanges, il existe une multitude de techniques pour identifier les constituants d'un mélange. Nous commencerons ici par de premières techniques simples qui consistent à identifier les espèces chimiques.
1) Des propriétés physiques à l'identification
Afin d'identifier des produits chimiques, il est possible d'utiliser leurs propriétés physiques qui leur sont caractéristiques :
| Propriété physique étudiée | Techniques employées |
| Température de changement d'état | Faire fondre un solide sur un banc Kofler - Mesurer la température d'ébullition d'un liquide. |
| Solubilité | Tester des ions par précipitation - Mesurer la concentration maximale d'un soluté dans un solvant (saturation) |
| Densité - Masse volumique | Par mesure de masse et de volume ou par utilisation d'un densimètre. |
| Couleur - Forme | Par analyse visuelle de la substance étudiée |
| Indice de réfraction | Mesurer l'indice de réfraction d'un liquide à l'aide d'un réfractomètre |
| Affinité avec un solvant et une phase solide | Chromatographie |
Ces techniques seront vues au fur dans cette séquence, et dans d'autres durant l'année scolaire.
2) Températures et changement d'état
La température de changement d'état est caractéristique d'un corps pur. Les noms des changements d'état sont universels et identiques quelque soit le corps. On rappelle ici ces noms :
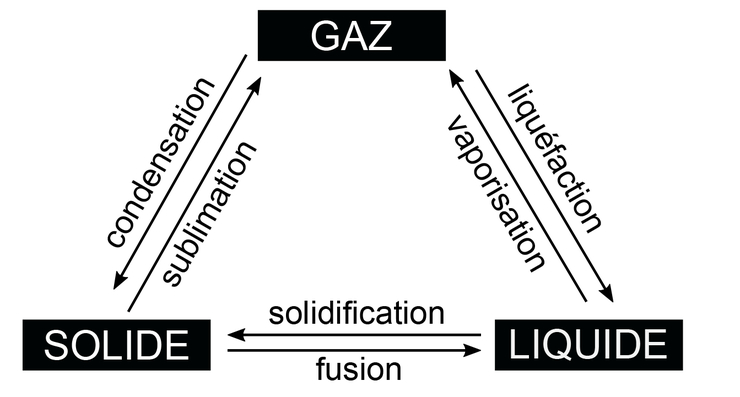
Nous rappelons aussi un résultat vu en classe de 5ème : la température de changement d'état d'un corps pur est constante. Ce n'est pas le cas pour un mélange.
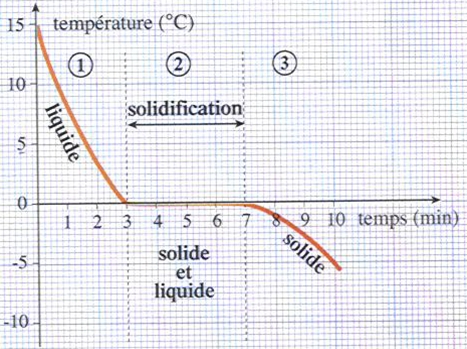 |
Courbe d'évolution de la température en fonction du temps pour un corps pur | 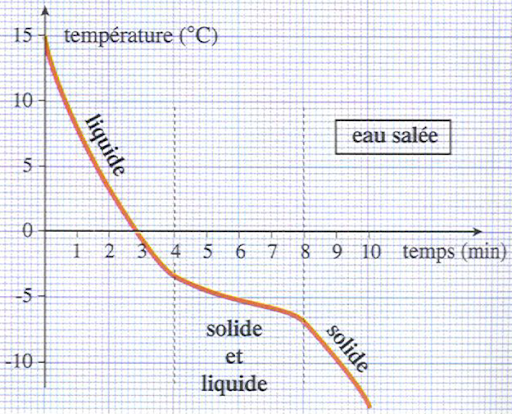 |
Courbe d'évolution de la température en fonction du temps pour un mélange |
3) Masse volumique
On définit la masse volumique de la façon suivante :
Définition : La masse volumique d'un corps pur correspond à la masse par unité de volume de ce corps pur. Elle est notée \(\displaystyle \rho\) et se calcule par \(\displaystyle \rho=\dfrac{m}{V}\).
L'unité de la masse est le kilogramme et celle du volume est le mètrre-cube. La masse volumique s'exprime donc en kg.m-3. Elle peut aussi s'exprimer en g.L-1 ou en g.mL-1 moyennant quelques conversions.
Quelques masses volumiques :
| eau | éthanol | huile d'olive | fer | air | |
| masse volumique en g.L-1 | 1000 | 789 | 920 | 7860 | 1,3 |
Remarque : La masse volumique varie légèrement avec la température. Cette variation sera négligée en classe de seconde. La masse volumique sera donc considérée comme constante.
4) Tests chimiques
Certaines espèces chimiques peuvent être identifiées dans un échantillon de matière par des tests chimiques. Quelques uns sont à connaître :
| Espèce chimique recherchée | Test effectué | Résultat du test s'il est positif |
| eau (H2O) | Dépôt sur du sulfate de cuivre anhydre | Le sulfate de cuivre anhydre est blanc. Au contact de l'eau, il devient bleu. |
| dihydrogène (H2) | Approche d'une flamme auprès du gaz | Une détonation a lieu |
| dioxygène (O2) | Approche d'une allumette incandescente | L'incandescence est ravivée |
| dioxyde de carbone (CO2) | Faire buller le gaz dans de l'eau de chaux | L'eau de chaux se trouble |
5) Chromatographie sur couche mince
La chromatographie est une technique de séparation et d'identification des constituants. Il en existe plusieurs. Celle étudiée ici est la chromatographie sur couche mince dont l'acronyme est C.C.M.
Le principe est d'utiliser la différence d'affinité des différentes espèces chimiques avec une phase mobile, appelée l'éluant, et une phase fixe, appelé le support.
Le protocole est résumé de la façon suivante :
• Préparer le support (plaque de silice) en traçant une ligne de dépot à 1,5 cm du bord.
• Déposer les espèces chimiques à étudier et comparer à l'aide d'un capillaire.
• Introduire la plaque dans la cuve à élution contenant environ 1 cm de hauteur d'éluant.
• Stopper l'élution, migration de l'éluant par capillarité le long de la plaque, avant que ce dernier n'atteigne le haut de la plaque.